Traitements en questions réponses
- Confirmer et enregistrer le diagnostic et le type de lymphome
- Présenter la synthèse des résultats du bilan d’extension du lymphome, évaluer et relire si besoin les données d’imagerie médicale, définir les facteurs de risque et les groupes pronostiques.
- Définir une attitude correspondant aux besoins de traitement ou la possibilité d’une abstention thérapeutique surveillance initiale, recommandée pour certains lymphomes indolents. Pour les lymphomes les plus fréquents un traitement standard de référence existe et ses modalités sont adaptées aux groupes de risque (groupes pronostiques thérapeutiques).
Lorsqu’un essai thérapeutique spécifique au type de lymphome et au groupe de risque existe et peut être proposé, cette possibilité est privilégiée par la RCP. Etablir un PPS.
Chaque fois qu’un essai clinique correspondant à votre lymphome est disponible et recommandé par la RCP, votre médecin référent vous proposera d’y participer. Dans certains cas, un(e) attaché(e) de recherche clinique complétera les informations données par votre médecin et répondra à vos questions relatives à l’essai clinique. Les réponses à vos questions sur les essais cliniques en cancérologie, sont réunies dans le guide de l’INCa.
- Evaluer la tolérance d’un nouveau médicament et définir la dose recommandée (essais de phase I).
- Evaluer l’efficacité d’un traitement (essais de phase II).
- Comparer un nouveau traitement avec le traitement standard de référence, en attribuant par tirage au sort à deux groupes comparables de patients l’un ou l’autre des traitements (essais de phase III).
Lorsque les différentes phases de développement sont en faveur du nouveau traitement, un dossier d’enregistrement est soumis aux autorités de santé, en vue d’une autorisation de mise sur le marché (AMM), autorisant la commercialisation du nouveau traitement.
- Définir le traitement de référence d’un lymphome pour un groupe homogène de patients ayant les mêmes caractéristiques et facteurs de risque.
- Améliorer le rapport bénéfice/risque d’un traitement standard de référence, en le comparant à un traitement dit expérimental dont les effets secondaires sont à priori plus réduits (choix des médicaments, réduction du nombre de cycles…) et l’efficacité équivalente.
- Evaluer le rapport bénéfice/risque d’un traitement d’entretien après traitement initial, dans le but de réduire le risque de rechute.
- Evaluer la tolérance et l’efficacité de nouveaux traitements chez les patients dont le lymphome n’est pas contrôlé par le traitement initial.
Le volume sur lequel le traitement est dirigé et les tissus à protéger sont définis avec précision par un scanner-simulateur de centrage sur la zone à traiter, permettant d’obtenir une image en trois dimensions. L’étendue des volumes traités est réduite et limitée au site tumoral. Les irradiations étendues et de l’abdomen sont abandonnées. L’irradiation corporelle totale utilisée pour le conditionnement de certaines greffes de moelle reste une modalité spécifique qui tend à être remplacée par une chimiothérapie intensive exclusive.
La dose délivrée ne dépasse pas 30 grays dans la majorité des cas. Les limites du volume cible et la répartition de la dose dans la zone à traiter sont définis en utilisant l’imagerie diagnostique, en particulier le PET-scanner dont les images sont superposées (fusionnées) avec celles du scanner-simulateur. Ces techniques, assistées par ordinateur, permettent une dosimétrie précise en trois dimensions et une protection optimale des organes et tissus sains (moelle épinière, thyroïde, glandes salivaires, cœur, seins).
Des contrôles systématiques sont réalisés pendant le traitement.
Le radiothérapeute, le physicien et l’équipe de manipulatrices (teurs) mettent en œuvre tous les moyens de la radiothérapie et des techniques modernes comme la radiothérapie conformationnelle avec modulation d’intensité, la radiothérapie synchronisée avec la respiration, pour permettre un traitement adapté à chaque patient et réduire les risques d’effet secondaire.
Les indications de la radiothérapie des lymphomes sont mieux définies, plus spécifiques et moins fréquentes.
Le lymphome de Hodgkin classique de stades localisés sus-diaphragmatiques reste la principale indication de la radiothérapie des lymphomes. Dans ces formes la chimiothérapie est toujours réalisée avant la radiothérapie et cette dernière ne doit pas être utilisée seule.
La radiothérapie est abandonnée dans le traitement initial des lymphomes non hodgkiniens agressifs B avec atteinte ganglionnaire localisée, est rarement utilisée seule pour le traitement d’un lymphome folliculaire localisé et garde des indications spécifiques comme par exemple certains lymphomes cutanés et en cas de localisations osseuses.
Liens utiles
Le lymphome hodgkinien – la radiothérapie sur le site de l’Institut nationale du cancer
La radiothérapie sur le site du LYSA (The Lymphoma Study Association)
La greffe de cellules souches consiste à remplacer les cellules souches initiales qui ont cessé de se multiplier sous l’effet d’une chimiothérapie intensive et à stimuler la production des cellules sanguines. Le prélèvement de cellules souches pour autogreffe s’effectue chez le patient atteint de lymphome. Le donneur étant le receveur lui-même, il n’y a pas de risque de rejet contrairement à l’allogreffe (cellules souches provenant d’un donneur et nécessité d’un traitement immunosuppresseur).
Les différentes phases d’une autogreffe de cellules souches hématopoïétiques sont :
(1) le recueil du greffon autologue de cellules souches en quantité et qualité suffisantes (cellules CD34 positives), à partir du sang périphérique du patient, sous stimulation par facteur de croissance seul ou après une chimiothérapie dite de mobilisation lors de la récupération des globules blancs stimulée par facteur de croissance. Le prélèvement thérapeutique est réalisé à l’aide d’un appareil de circulation extra corporelle et une sélection des cellules CD34 du sang. Le greffon recueilli est congelé pour conservation. Le prélèvement du greffon autologue à partir de la moelle osseuse est rarement pratiqué.
(2) le conditionnement par chimiothérapie intensive (doses supérieures à celles de la chimiothérapie standard), à visée thérapeutique du lymphome et entrainant l’arrêt de la production par la moelle osseuse des cellules du sang (aplasie)
(3) la transfusion du greffon (autogreffe proprement dite)
(4) une aplasie raccourcie par la transfusion des cellules hématopoïétiques prenant le relais des cellules souches initiales pour produire les cellules du sang et permettant la sortie d’aplasie stimulée par facteur de croissance.
L’intensification thérapeutique ou conditionnement par chimiothérapie intensive à hautes doses suivi d’autogreffe de cellules souches périphériques regroupe ces différentes phases. L’autogreffe est un support de cellules souches permettant l’administration de la chimiothérapie intensive, et n’a pas de propriétés thérapeutiques sur le lymphome, contrairement à l’effet recherché par un greffon de donneur (allogreffe).
Liens utiles :
Les traitements intensifs et les thérapies cellulaires sur le site du LYSA
- Deux types d’approche sont possibles :
– Les thérapies ciblant la cellule tumorale qui interagissent avec des anomalies moléculaires ou les mécanismes de développement et dissémination des cellules cancéreuses pour bloquer la croissance ou la propagation de la tumeur.
– L’immunothérapie qui agit sur des cibles de la tumeur ou des cellules immunitaires de son environnement pour restaurer l’efficacité du système immunitaire et aboutir à la destruction des cellules cancéreuses.
- Est souvent mieux toléré que la chimiothérapie; cependant des effets secondaires différents peuvent être observés avec ces composés nouveaux.
Mieux cibler la tumeur pour assurer un meilleur traitement et un suivi adapté sous traitement.
La présence d’une anomalie moléculaire ne permet pas de garantir l’efficacité d’un traitement adapté aux anomalies génétiques. Les essais cliniques sont nécessaires pour évaluer l’efficacité et les effets secondaires dans chaque type de tumeur présentant une même anomalie. Un enjeu de la recherche est de disposer des biomarqueurs permettant d’identifier les patients qui à priori ne répondront pas et les patients susceptibles de répondre au traitement. L’objectif est important en termes de bénéfice-risque et de bénéfice-coût. Les plateformes de génétique moléculaires des cancers ont été créées pour offrir aux patients les différentes techniques de génétique moléculaires nécessaires pour différentes pathologies.
Liens utiles
Médecine de précision : thérapies ciblées et immunothérapie spécifique sur le site internet de l’Institut national du cancer
Les thérapies ciblées sur le site internet du Réseau Espace Santé-cancer, Rhône-Alpes
Les plateformes de génétique moléculaire des cancers sur le site internet de l’Institut national du cancer
Les tests ou marqueurs déterminant l’accès à des thérapies ciblées
Documents
Les thérapies ciblées dans le traitement du cancer en 2015 – Etat des lieux et enjeux. Disponible sur le site internet de l’Institut national du cancer
Médicaments immunomodulateurs (IMID) : Thalidomide, Lénalidomide, Pomalidomide. Anticancéreux par voie orale : informer, prévenir, gérer les effets indésirables. Disponible sur le site internet de l’Institut national du cancer
La stratégie de traitement guidé par la TEP après les 2 et/ou les 4 premiers cycles de chimiothérapie consiste à adapter le traitement en fonction de la réponse métabolique précoce. Les patients dont la TEP est négative reçoivent une chimiothérapie dont l’intensité ou la durée peut être réduite, afin de diminuer les possibles effets indésirables du traitement, sans compromettre le contrôle de la maladie. Les patients dont la TEP reste positive poursuivent une chimiothérapie dont l’intensité et la durée sont équivalentes au traitement de référence. La TEP précoce a été utilisée dans des essais thérapeutiques récents. Le traitement guidé par la TEP est recommandé pour les patients atteints de lymphome de Hodgkin classique et de lymphome diffus à grandes cellules B.
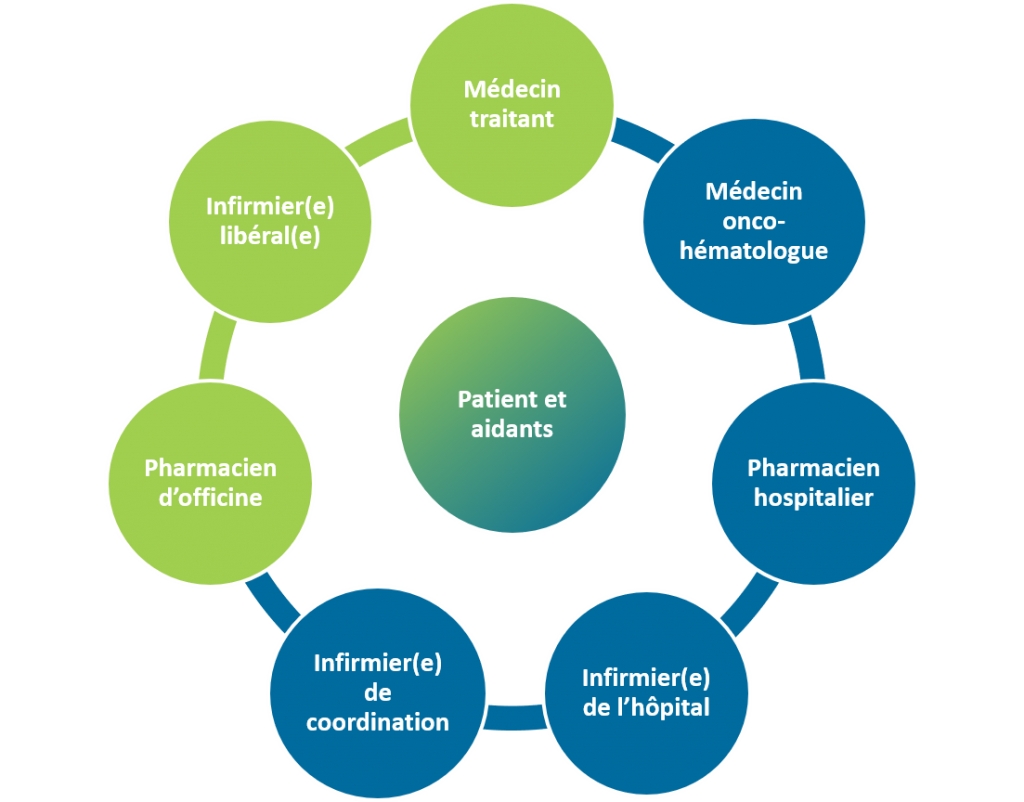
| Rôle et actions | Documents nécessaires à la prise en charge | |
|---|---|---|
| Patient et aidants | - Responsable, informé et impliqué dans sa prise en charge - Noter le traitement oral reçu par rapport au traitement prescrit et aux autres médicaments - Préparer la consultation avec l’onco-hématologue pendant le traitement du lymphome - Récupérer et communiquer les résultats de ses examens biologiques. - Participer à l’évaluation de la tolérance au traitement - Reconnaître les possibles effets indésirables et être réactif - Savoir quand, qui et comment contacter selon ses besoins - Être le relais d’informations pour les professionnels de santé - Être détenteur de son dossier médical - Décider qui a accès à son dossier médical et son dossier pharmaceutique | - Ordonnances du traitement - Plan de traitement et médicaments à domicile - Coordonnées médecin traitant, pharmacien d’officine, contacts avec l’équipe hospitalière |
| Médecin onco-hématologue | - Présenter le dossier du patient en réunion de concertation pluridisciplinaire (RCP) - Informer le patient des décisions de RCP - Consultation d’annonce - Consultation de primo-prescription du traitement oral - Informer le médecin généraliste - Informer le pharmacien hospitalier - Activités de recherche clinique - Demande d’autorisation temporaire d’utilisation (ATU) | - Programme Personnalisé de Soins (PPS) - Dossier communiquant de cancérologie (DCC) |
| Médecin traitant | - Médecin de 1er recours, joignable par le patient | - Accès facilité avec le service hospitalier (lignes téléphoniques dédiées) - Plateformes sécurisées hôpital – médecin de ville |
| Pharmacien hospitalier | - Entretien pharmaceutique de primo-prescription - Informer et conseiller le patient sur le traitement oral du lymphome - Expliquer observance et conduite à tenir en cas d’oubli de prise - Préciser les traitements associés et rechercher les automédications - Conciliation médicamenteuse - Analyser les interactions médicamenteuses potentielles - Dispenser les thérapies ciblées non disponibles en ville - Informer le pharmacien d’officine | - Remise au patient d’informations et documents (fiche de bon usage, plan de traitement, carnet de suivi) - Dossier pharmaceutique |
| Pharmacien d’officine | - Entretien pharmacien-patient - Evaluer l’adhésion thérapeutique - Rechercher les interactions médicamenteuses potentielles - Mettre à jour le dossier pharmaceutique - Demander au patient de décider qui a accès à son dossier pharmaceutique | - Ordonnances de traitement - Dossier pharmaceutique |
| Infirmier(e) de l’hôpital | - Compléter les informations sur le traitement ambulatoire - Education thérapeutique du patient | - Information des soignants sur les nouveaux traitements oraux |
| Infirmier(e) libéral(e) | - Aider le patient au bon déroulement du traitement oral - Evaluer l’observance thérapeutique et la tolérance des médicaments - Assurer la traçabilité du traitement - Vérifier les conditions de conservation et de stockage des médicaments | - Fiches d’Information sur les nouveaux traitements oraux - Accès facilité avec le service hospitalier (lignes téléphoniques dédiées, N° vert) |
| Infirmier(e) de coordination | - Articulation des acteurs des réseaux de soins |
Est-il possible de traiter un lymphome sans chimiothérapie ?
Oui ? Certains médicaments ont déjà une autorisation de mise sur le marché (AMM), mais pas encore pour le traitement initial du lymphome. En revanche, cela est envisageable, seulement en monothérapie, en rechute ou en situation de résistance au traitement et même dans des phases avancées de la maladie.
Quels sont les médicaments utilisés hors essais cliniques ?
Les médicaments utilisés sont de trois types :
– les anticorps monoclonaux
seuls : Rituximab et Obinutuzumab
anticorps anti-PD1 : Nivolumab et Pembrolizumab
– les immunomodulateurs
Lenalidomide
– les thérapies ciblées
Inhibiteurs de kinases : Idelalisib et Ibrutinib
Inhibiteur de la protéine BCL-2 : Vénétoclax
Quelles sont les indications de ces médicaments dans les soins courants?
Le 1er médicament ayant reçu une autorisation est le Rituximab pour le traitement du lymphome folliculaire en rechute de stade III-IV.
Plusieurs médicaments ont reçu une AMM depuis :
– Lenalidomide pour le lymphome à cellules du manteau en rechute
– Idelalisib pour le lymphome folliculaire en rechute après deux lignes de traitement antérieures
– Ibrutinib pour le lymphome à cellules du manteau en rechute ou réfractaire
D’autres médicaments ont une AMM mais leurs conditions de remboursement rendent leur utilisation compliquée.
– Nivolumab, pour le traitement des adultes atteints d’un lymphome de Hodgkin classique (LHc) en rechute ou réfractaire après une greffe de cellules souches hématopoïétiques autologues (GCSA) et un traitement par brentuximab vedotin (ADCETRIS).
– Pembrolizumab, en monothérapie pour le traitement des patients adultes atteints d’un lymphome de Hodgkin classique (LHc) en rechute ou réfractaire après échec d’une greffe de cellules souches (GCS) autologue et d’un traitement par brentuximab vedotin (BV), ou inéligibles à une greffe et après échec d’un traitement par BV.
– Vénétoclax n’a à ce jour aucune AMM dans le traitement des lymphomes.
Peut-on utiliser ces médicaments en association ?
De nombreuses études sont terminées, en attente de résultats ou récemment publiées.
L’association R2 (Rituximab + Revlimid) en rechute dans les lymphomes folliculaires comme en 1ère ligne permet un contrôle du lymphome similaire au R-CHOP mais avec un profil de toxicité différent.
De nouvelles molécules dans plusieurs indications sont développées dans des études en cours associant les thérapies ciblées de 2ème génération avec les anticorps monoclonaux de 2ème génération. Par exemple Obinutuzumab (AC anti CD 20) + immunomodulateur (Lenalidomide, essai Galen) ou inhibiteur de BTK.
L’association de plusieurs médicaments d’immunothérapie n’est pas recommandée dans les soins courants, mais est possible dans le cadre des essais cliniques.
Traitement des lymphomes sans chimiothérapie – Essais cliniques
| Médicaments | Essais cliniques | Indications | Référence |
| Rituximab + Lenalidomide | RELEVANCE LYSA Phase 3 | L Folliculaire Formes avancées 1ère ligne | Morschhauser et al. N Engl J Med. 2018 |
| Obinutuzumab + Lenalidomide | GALEN LYSA | Lymphomes B agressifs Rechute/réfractaire | Houot et al. Leukemia 2018 |
| Obinutuzumab + Lenalidomide | Phase 1b | Lymphome Folliculaire Rechute / réfractaire | Morschhauser et al. Blood 2018 |
| Lenalidomide + Rituximab | Phase 2 | Lymphome à cellules du manteau 1ère ligne | Ruan et al. Blood 2018 |
| Ibrutinib, Lenalidomide et Rituximab | PHILEMON Phase 2 | Lymphome à cellules du manteau Rechute / réfractaire | Jerkeman et al. Lancet Haematol 2018 |
| Ibrutinib et Rituximab | Phase 2 | Lymphome à cellules du manteau Rechute / réfractaire | Jain et al Br J Haematol 2018 |
| Ibrutinib + venetoclax | Phase 2 | Lymphome à cellules du manteau Rechute / réfractaire | Tam et al. N Engl J Med 2018 |
| Ibrutinib versus Temsilorimus | RAY Phase 3 | Lymphome à cellules du manteau antérieurement traité | Rule et al Leukemia 2018 |
| Acalabrutinib | ACE-LY-004 | Lymphome à cellules du manteau Rechute / réfractaire | Wang et al Lancet 2018 |
Ces traitements ont-ils des effets indésirables comme la chimiothérapie ?
Les effets secondaires des thérapies ciblées sont nombreux, pour certains fréquents, parfois graves. Ils sont différents de la chimiothérapie, doivent être connus et reconnus tôt. Une augmentation du volume tumoral au début du traitement est possible et peut faire craindre une inefficacité.
Certains médicaments nécessitent une prise à distance des repas et des aliments peuvent être interdits. En raison de nombreuses interactions médicamenteuses possibles, la connaissance des traitements concomitants est importante, l’automédication est à éviter de même que le traitement par les plantes (ex : millepertuis).
Les patients reçoivent leur traitement à domicile. Il est donc primordial d’informer l’infirmier(e) libéral(e), le pharmacien et le médecin généraliste. Une bonne coordination ville – hôpital est fondamentale.

Les effets indésirables des thérapies ciblées et de l’immunothérapie spécifique
Conditions et questions spécifiques au traitement sans chimiothérapie
Le bon usage des thérapies ciblées orales nécessite une complémentarité optimale entre la ville et l’hôpital. Ces médicaments sont très onéreux et sont prescrits pour des durées très longues (jusque progression en cas de bonne réponse). Les taux élevés de rémission complète en traitement de 1ère ligne sont prometteurs. Ces molécules différentes de la chimiothérapie et utilisées seules, le plus souvent ne permettent pas d’obtenir une guérison définitive du lymphome. Les associations de ces médicaments ouvrent des perspectives encourageantes.

Traitement du lymphome sans chimiothérapie
Conditions et questions
Pour quels lymphomes ?
Lymphome folliculaire le plus souvent, lymphomes de la zone marginale (splénique et certains lymphome de MALT non gastrique), lymphome lymphocytique, lymphome lymphoplasmocytaire, lymphome de Hodgkin nodulaire à prédominance lymphocytaire (différent du lymphome de Hodgkin classique qui nécessite toujours un traitement).
Ces lymphomes ont souvent une évolution dite indolente, par opposition aux lymphomes agressifs qui nécessitent d’emblée un traitement. Les caractéristiques du lymphome lors du diagnostic qui permettent de proposer une abstention thérapeutique ont été décrites principalement pour le lymphome folliculaire. Les critères couramment utilisés pour le lymphome folliculaire sont les suivants (GELF): aucune masse de 7 cm ou plus, pas plus de 3 sites ganglionnaires atteints de moins de 3 cm, absence de signes généraux, absence de splénomégalie symptomatique, absence d’épanchement, hémoglobine et LDH sériques normaux. Pour les autres lymphomes, ces critères sont complétés par des paramètres biologiques (plaquettes, Béta2-microglobuline…)
Le plus souvent, il s’agit d’un ou plusieurs ganglions isolés sans symptômes cliniques.
Abstention thérapeutique, pourquoi ?
Les études déjà anciennes portant sur le lymphome folliculaire et comparant un groupe de patients traités d’emblée et un groupe de patients en abstention thérapeutique initiale et traités plus tardivement, ont montré que ces derniers avaient une espérance de vie proche de celle de personnes qui n’ont pas de lymphome.
L’abstention thérapeutique est devenue une pratique courante ; elle permet de ne pas initier un traitement dont le bénéfice pour le patient n’est pas certain, et réserver la mise en œuvre du traitement au moment où cela devient nécessaire. Le patient n’est donc pas exposé d’emblée aux inconvénients du traitement et peut même dans certains cas bénéficier de nouveaux traitements qui n’étaient pas disponibles lors du diagnostic initial.
Comment annoncer l’abstention thérapeutique
La décision de ne pas traiter est habituellement proposée par une réunion de concertation pluridisciplinaire. Bien qu’il n’y ait pas de traitement, la consultation d’annonce par l’onco-hématologue permet d’apporter au patient, à son entourage et au médecin traitant les informations sur les raisons de l’abstention thérapeutique et les modalités de la surveillance. L’acceptation de l’abstention thérapeutique par le patient et sa participation à la surveillance peut nécessiter de le revoir après un court délai.
Surveillance
La surveillance peut être partagée entre le médecin traitant et l’onco-hématologue. Ce dernier doit être facilement joignable et disponible pour une consultation anticipée selon les besoins du patient et l’évolution possible du lymphome. Le patient bien informé, a un rôle important pour rester réactif en cas de symptômes nouveaux et consulter sans attendre une consultation programmée plus tardive.
Les données cliniques sont prioritaires sur les examens complémentaires, ce d’autant qu’il s’agit souvent d’un ganglion périphérique palpable, pour les lymphomes maintenus en abstention thérapeutique.
La durée de l’abstention thérapeutique est très variable. Dans les études non récentes, la moitié des patients restaient sans traitement pendant 3 ans. Actuellement, l’abstention est souvent plus longue, en raison du diagnostic précoce du lymphome lors de sa découverte fortuite, à l’occasion d’un examen clinique ou un scanner réalisé pour un autre motif. Une abstention thérapeutique prolongée n’est donc pas rare, certains lymphomes non-folliculaires ne sont jamais traités.
Laisser un patient atteint de lymphome sans traitement n’est pas préjudiciable, à condition qu’il accepte une surveillance et qu’il puisse facilement anticiper une consultation en cas de besoin.
Télécharger la fiche : Lymphome de Hodgkin localisé TEP scanner avant traitement
La tolérance de l’anémie, variable pour chaque patient, dépend en partie de sa rapidité de survenue et donc de sa /ses cause(s). Le traitement de l’anémie est fonction de son importance, de son évolution liée en partie à sa cause, et du rapport bénéfice-risque de chaque traitement. Le recours possible aux transfusions nécessite pour le patient d’en être informé, de les comprendre et de les accepter.
Causes de l’anémie
| Liée au lymphome | |
|---|---|
| Insuffisance médullaire | Infiltration de la moelle osseuse par certains lymphomes indolents |
| Syndrome inflammatoire | Diminution de l’utilisation du fer pour la synthèse d’hémoglobine |
| Hémolyse | Destruction des globules rouges |
| Traitements | |
| Chimiothérapie | |
| Radiothérapie (rarement) | |
| Autres causes non spécifiques du lymphome | |
| Saignement chronique (digestif, gynécologique) et carence en fer | |
| Insuffisance rénale (diminution de production d’érythropoïétine) | |
| Déficit en acide folique (vitamine B9), vitamine B12 | |
Dans certains cas, l’anémie est secondaire à plusieurs causes associées.
Traitement de l’anémie
Transfusions de concentrés de globules rouges (CGR)
Ce qu’il faut savoir :
Pour recevoir une transfusion de CGR, le patient doit avoir été informé et donné son consentement qui doit figurer dans le dossier médical.
Sécurité des produits transfusés: Les concentrés de globules rouges (CGR) sont des produits sanguins labiles (PSL) préparés par l’Etablissement Français du Sang (EFS) selon un processus très rigoureux avec risque infime de transmission virale ou bactérienne. Les CGR sont transfusés par un personnel qualifié. L’Infirmière procède à des contrôles de concordance d’identité et de groupe entre le patient, la poche de sang et.la prescription médicale. Préalablement à toute transfusion un test de contrôle ultime est réalisé en présence du patient entre le sang du receveur et celui du donneur pour éviter toute erreur de compatibilité sanguine. Les CGR sont conservés dans un container isotherme pour éviter les chocs thermiques et maintenir une température entre 2 et 10°C. La durée de transfusion d’un CGR est d’environ 90 mn.
Effets secondaires possibles des transfusions de CGR : Réaction fébrile et surcharge en volume sont les effets secondaires immédiats les plus recensés à plus ou moins long terme: risque d’immunisation et de surcharge en fer en cas de poly transfusions.
Connaître le vocabulaire des soignants
- Carte de groupe sanguin ABO avec phénotype Rhésus et Kell; groupe ABO avec phénotype élargi en cas de projet de greffe de moelle allogénique.
- RAI, recherche d’agglutinines irrégulières : Recherche dans le sang du receveur d’anticorps dirigés contre les antigènes de groupes sanguins du donneur.
- CGR phénotypés : CGR compatibles dans le système ABO, Rhésus et Kell.
- CGR irradiés : l’irradiation des CGR permet de détruire les cellules nucléées comme les lymphocytes et d’éviter la réaction du greffon contre l’hôte (GVH) post transfusionnelle.
- CGR compatibilisés: En cas de RAI positive, préalablement à la transfusion, les globules rouges du donneur sont testés en présence de plasma du receveur. Un test négatif autorise la transfusion
- Quantité de CGR transfusés, habituellement 2 unités de CGR par transfusion
Autres traitements de l’anémie
Agents stimulant de l’érythropoïèse (ASE) ou dans le langage courant érythropoïétine, EPO. Traitement administré par voie sous cutané en général sous forme d’injections hebdomadaires. Traitement débuté le plus souvent si le taux d’hémoglobine est inférieur à 10-11 g/dL et arrêté si le taux d’hémoglobine est supérieur à 12 g/dL. Pendant le traitement par EPO, la surveillance du taux d’hémoglobine est effectuée au moins tous les 15 jours.
Traitement par le fer seulement en cas de carence en fer confirmée par la biologie
Anémie par hémolyse, le traitement de l’origine de l’hémolyse est privilégié, le recours aux transfusions n’est pas systématique et nécessite des précautions particulières.
La prise en charge de l’anémie varie en fonction du patient, du lymphome et du traitement
Exemples
- Patient âgé de 30 ans atteint d’un lymphome de Hodgkin avec syndrome inflammatoire, anémie avant traitement hémoglobine 8,5 g/dl, indication d’une chimiothérapie par BEACOPPInformation par le médecin avant traitement et prescription des hémogrammes de surveillance. Traitement de l’anémie : indication d’un traitement par EPO dès le début de la chimiothérapie (prescription EPO, en générale 30 000 UI en sous-cutané une fois par semaine. Le traitement doit être interrompu si hémoglobine > 12 g/dl) et possibles transfusions de CGR, dans ce cas réalisation d’une prise de sang avec recherche d’agglutinines irrégulières datant de moins de 3 jours.Rôle du patient : Les résultats de prises de sang sont adressés au prescripteur par le laboratoire. Il est préférable que le patient puisse également récupérer les résultats des prises de sang et si besoin contacter l’équipe soignante ou le médecin traitant.
- Patiente âgée de 66 ans en bon état général, sans anémie initiale, atteinte d’un lymphome folliculaire nécessitant un traitement par Rituximab et chimiothérapie CHOP.Information par le médecin avant traitement et prescription des contrôles d’hémogrammes.Surveiller l’apparition d’une anémie et la traiter soit d’emblée par EPO, soit plus tardivement selon l’évolution.
- Patient âgé de 68 ans atteint d’un lymphome des cellules du manteau, anémie initiale modérée hémoglobine 10 g/dl, indication d’un traitement par Rituximab et chimiothérapie DHAC (Aracytine haute dose et Carboplatine)Information par le médecin avant traitement…Anticiper l’aggravation possible de l’anémie en débutant un traitement par EPO.
Rédaction avec la participation du Docteur Caroline Sol-Touati, Praticien Hospitalier, responsable Hémovigilance CHU de Limoges.
Le risque hémorragique dépend de l’importance de la thrombopénie et peut être majoré par un traitement anticoagulant ou antiagrégant plaquettaire (aspirine à faible dose) concomitant pour une pathologie associée.
Le patient participe à la surveillance pendant le traitement, en lien avec l’équipe soignante.
Le recours possible aux transfusions de plaquettes repose sur des critères définis par l’équipe soignante (signes hémorragiques, seuil transfusionnel, efficacité des transfusions…)
Causes de la thrombopénie
Traitements
Chimiothérapie : Certains protocoles avec intensité de doses de chimiothérapie comme par exemple ceux comportant un sel de platine (DHAC) peuvent induire une diminution transitoire de la production de plaquettes et une thrombopénie. D’autres protocoles standards comme ABVD (lymphome de Hodgkin), CHOP (lymphome non hodgkinien) sont rarement à l’origine de thrombopénie.
Insuffisance médullaire par infiltration de la moelle osseuse par certains lymphomes, la thrombopénie est rarement profonde, mais peut être aggravée temporairement par une chimiothérapie.
A côté des thrombopénies liées à la diminution de production médullaire des plaquettes, les thrombopénies secondaires à une destruction/consommation accrue des plaquettes (thrombopénies périphériques) ne sont pas habituellement traitées par transfusions mais par d’autres traitements comme les corticoïdes, les immunoglobulines, un agoniste des récepteurs de la thrombopoïétine.
Traitement
Pour recevoir une transfusion de plaquettes, le patient doit avoir été informé et donné son consentement qui doit figurer dans le dossier médical.
Groupe ABO, Rhésus
Transfusion de concentré plaquettaire standard (CPS) issu de plusieurs donneurs (mélange de concentrés plaquettaires (MCP) ou concentré plaquettaire d’aphérèse (CPA) issu d’un seul donneur.
Une thrombopénie modérée ne nécessite pas de transfusion, mais parfois une surveillance rapprochée.
Seuil transfusionnel et indications : en général si plaquettes inférieures à 10 000 – 20 000/mm3 ou inférieures, à 50 000/mm3 si patient sous anticoagulant.
L’efficacité des transfusions plaquettaires est de durée courte, le plus souvent 2 à 3 jours, mais parfois quelques heures, d’où la nécessité de réaliser dans certaines situations plusieurs transfusions plaquettaires rapprochées. Parfois, il sera nécessaire de contrôler le taux plaquettaire après transfusion lorsque l’on a un doute sur le rendement transfusionnel.
Effets secondaires possible des transfusions de CPS / CPA : pendant ou au décours d’une transfusion peuvent survenir frissons, fièvre, éruption cutanée. Si besoin, une prémédication par Polaramine avant transfusion permet de limiter ou éviter ces réactions sans gravité et spontanément résolutives.
Sécurité des produits transfusés Les concentrés plaquettaires sont des produits sanguins labiles (PSL) préparés par l’Etablissement Français du Sang (EFS) selon un processus très rigoureux avec risque infime de transmission virale ou bactérienne. Actuellement, l’inactivation virale se fait par Amotosalem. Lors de l’acheminement, les concentrés plaquettaires sont maintenus à température ambiante dans un container isotherme (température de conservation entre 20-24°C). Les transfusions sont réalisées par un personnel qualifié. Une transfusion plaquettaire se déroule en 15 – 20 mn.
La prise en charge de la thrombopénie dépend principalement du traitement du lymphome
Exemple
- Patient âgé de 42 ans atteint d’un lymphome de Hodgkin en rechute, sans thrombopénie avant traitement, indication d’une chimiothérapie par DHAC comportant du Carboplatine et de l’Aracytine avec intensité de dosesInformation par le médecin sur l’auto-surveillance et prescription des hémogrammes de surveillance.Les résultats des prises de sang sont adressés au prescripteur par le laboratoire.Le patient surveille l’apparition possible de signes hémorragiques mineurs sur la peau, les gencives et récupère les résultats des prises de sang pour contacter l’équipe soignante si besoin.
Recourir à des transfusions de CPS ou CPA si plaquettes à 20 000/mm3 ou inférieures à 50 000/mm3 si patient sous anticoagulant, ou syndrome hémorragique.
Rédaction avec la participation du Docteur Caroline Sol-Touati, Praticien Hospitalier, responsable Hémovigilance CHU de Limoges.
