TEP au FDG

La TEP-TDM (TEP scanner) associe un examen scanner au TEP et s’intègre dans le bilan initial des lymphomes B à grandes cellules et le lymphome de Hodgkin. Pour les autres entités de lymphomes, elle n’est pas systématique et reste à évaluer.
Réalisée en fin de traitement, elle permet un classement de la réponse selon des critères validés pour les lymphomes B à grandes cellules et le lymphome de Hodgkin.
La TEP réalisée pendant le traitement est en cours d’évaluation pour le lymphome de Hodgkin et les lymphomes B à grandes cellules.
La place de la TEP est moins bien définie pour le lymphome folliculaire, le lymphome des cellules du manteau et les autres lymphomes.
La TEP n’a pas d’intérêt reconnu pour le suivi des patients atteints de lymphome après obtention d’une rémission complète.
TEP-FDG, critères de Deauville (Echelle 5 points)
| Score | Résultat TEP-FDG | Catégorie |
|---|---|---|
| 1 : Absence de fixation supérieure au bruit de fond | TEP-FDG négative | 1 réponse métabolique complète |
| 2 : Fixation < au médiastin | TEP-FDG négative | 1 réponse métabolique complète |
| 3 : Fixation > médiastin mais < foie. Si la fixation du compartiment sanguin du médiastin est >= à celle du foie, l’activité de la lésion doit être comparée à la fixation hépatique. Fixation de la lésion < fixation hépatique = score 2 Fixation de la lésion >= fixation hépatique = score 3 | TEP-FDG négative | 1 réponse métabolique complète |
| 4 : Fixation modérée comparée à la fixation du foie | TEP-FDG positive | 2 réponse métabolique partielle |
| 5 : Augmentation prononcée de la fixation comparée à la fixation du foie | TEP-FDG positive | 3 absence de réduction significative de l’absorption ou apparition de nouvelles lésions. |
Score 1, 2 ou 3 = TEP-FDG négative
Score 4, 5 fixation supérieure à la fixation du foie = TEP-FDG positive
Références
Meignan M, Haioun C, Gallamini A. Report on the First International Workshop on interim-PET-scan in lymphoma. Leuk & Lymphoma 2009 Aug ;50(8) :1257-60.
Meignan M, Gallamini A , Itti E , Barrington S, Haioun C, Polliack A. Report on the third international workshop on Interim Positron Emission Tomography in lymphoma held in Menton, France, 26 – 27 September 2011 and Menton 2011 consensus. Leuk Lymphoma. Leuk Lymphoma. 2012 Oct;53(10):1876-81.
Meignan M, Barrington S, Itti E, Gallamini A, Haioun C, Polliack A. Report on the 4th International Workshop on Positron Emission Tomography in Lymphoma held in Menton, France, 3-5 October 2012. Leuk Lymphoma. 2014 Jan;55(1):31-7.
La TEP est recommandée pour tous lymphomes avides de FDG et en cas de suspicion de transformation histologique d’un lymphome peu avide de FDG (lymphome lymphocytique/LLC, lymphome du MALT), pour évaluer l’indication et les modalités d’une biopsie.
Evaluation de la réponse en cours de traitement
La TEP précoce après 2 cycles de chimiothérapie ou intermédiaire (après 4 cycles) est recommandée pour évaluer la chimio-sensibilité du lymphome de Hodgkin et des lymphomes B diffus à grandes cellules, avec un impact possible sur la poursuite du traitement.
TEP de fin de traitement
Recommandée pour les lymphomes avides de FDG, afin de confirmer la rémission complète avant surveillance qui ne comporte pas de TEP systématique.
Lymphome de Hodgkin classique
La TEP initiale permet de ne plus réaliser de biopsie ostéo-médullaire, dans les formes localisées sus-diaphragmatiques, dont le traitement peut comporter une chimiothérapie suivie de radiothérapie. Pour définir avec précision les volumes irradiés sur les ganglions initialement atteints en superposant la TEP initiale et le scanner de centrage de la radiothérapie, il est recommandé de réaliser la TEP initiale en position de radiothérapie (bras le long du corps) [Peignaux-Casasnovas K, 2021].
L’évaluation de la réponse en cours de traitement, comporte pour tous les stades et quelle que soit la chimiothérapie initiale, une TEP précoce après 2 cycles (TEP2) et pour les formes avancées une TEP intermédiaire après 4 cycles (TEP4). Les essais cliniques ont confirmé la possibilité d’un traitement guidé par la TEP. Les patients atteints de formes avancées, ayant une TEP2 négative peuvent poursuivre le traitement dans le cadre d’une désescalade thérapeutique. Une TEP positive justifie une corrélation avec les données cliniques et du scanner, pour décider d’un contrôle histologique.
La TEP de fin de traitement ne doit pas être réalisée trop tôt après la fin de la radiothérapie.
La TEP réalisée pour suspicion et diagnostic de progression ou rechute permet de définir les modalités d’une biopsie. Lorsque le traitement comporte une intensification thérapeutique, la TEP est réalisée pendant la chimiothérapie de réduction tumorale ou/et avant autogreffe de cellules souches hématopoïétiques.

Lymphomes B diffus à grandes cellules / Lymphomes primitifs du médiastin
La TEP initiale permet de ne pas réaliser de biopsie ostéo-médullaire de façon systématique, mais seulement en fonction des résultats de la TEP.
En cours de traitement, la TEP est réalisée après 2 et 4 cycles de rituximab-chimiothérapie et permet un traitement guidé par la TEP chez les patients âgés de 18 à 80 ans avec IPIaa = 0 et les patients âgés de moins de 61 ans avec IPIaa > 1.
La TEP réalisée en fin de traitement est recommandée.
Lorsque le traitement comporte une intensification thérapeutique avec autogreffe, en 1ère ligne ou en traitement de rattrapage après échec-rechute, la TEP réalisée avant autogreffe a une valeur prédictive pour la survie sans progression et la survie globale [Noring 2021, Dickinson 2010, Spaepen 2003].

Lymphome folliculaire
La TEP réalisée en fin de traitement d’induction et avant traitement d’entretien par rituximab a une valeur prédictive pour la survie sans progression [Barrington 2021]. Cependant, un changement de traitement décidé sur le seul résultat de TEP positive, n’est pas consensuel mais discuté au cas par cas avant un traitement de 2ème ligne.

Lymphome à cellules du manteau
En cours de traitement, la TEP est réalisée chez le sujet jeune après 4 cycles de rituximab-chimiothérapie ou/et avant intensification autogreffe. Chez les patients âgés, traités sans intensification autogreffe, la TEP peut être réalisée en fin de traitement selon les pratiques de chaque centre.

Lymphomes T périphériques
La TEP peut être réalisée en cours de traitement mais reste peu décisionnelle.
Traitement par cellules CAR-T
La TEP est réalisée avant lymphodéplétion et administration des cellules CAR-T et a une valeur prédictive pour la survie globale [Vercellino 2020]. Pour le suivi après traitement, un consensus conduit à réaliser une TEP un mois après administration des cellules CAR-T puis tous les 3 mois au cours de la 1ère année (3 mois, 6 mois, 9 mois, 12 mois).
Les stratégies TEP guidées : un nouveau standard de la prise en charge du lymphome de Hodgkin classique
La réduction du métabolisme tumoral évaluée par la TEP au FDG après les 2 premiers cycles de chimiothérapie reflète la chimiosensibilité tumorale et a démontré une valeur pronostique supérieure à celle des index pronostiques et notamment du score pronostique international (IPS).
Sur la base de la valeur pronostique de la TEP précoce, des stratégies TEP guidées ont été développées permettant d’adapter le traitement aux facteurs de risque initiaux et à la réponse métabolique à 2 cycles tant dans les formes localisées que disséminées. Ces approches ont été évaluées dans le cadre d’essais thérapeutiques provenant de différents groupes dont les résultats sont maintenant disponibles, et déjà publiés ou en cours de publication.
Ces résultats incitent à modifier la prise en charge des patients dans la pratique courante car ils impactent significativement les chances de contrôle de la maladie en limitant les risques de toxicité à long terme. Aussi une TEP après les 2 premiers cycles de chimiothérapie (TEP2) doit être proposée à tous les patients pour adapter la stratégie.
– Dans les stades localisés sus diaphragmatiques de lymphome de Hodgkin, si la TEP est positive après 2 cycles d’ABVD une intensification par BEACOPP suivi d’une irradiation permet d’obtenir un meilleur contrôle tumoral qu’une poursuite de l’ABVD suivi d’une irradiation 1.
– Dans les formes disséminées :
– Quand un choix de traitement de première ligne par ABVD a été fait, si la TEP2 est positive une intensification par BEACOPP permet d’obtenir un meilleur contrôle tumoral qu’une poursuite de l’ABVD; 2, 3, 4 si la TEP est négative la poursuite de l’ABVD est possible en omettant la bléomycine ce qui diminue la toxicité du traitement sans compromettre le contrôle de la maladie. 4
– Quand un choix de traitement de première ligne par BEACOPP a été fait, la TEP après 2 cycles est négative dans environ 85% des cas et permet un traitement moins intense par ABVD avec un contrôle tumoral similaire à celui obtenu avec 6 cycles de BEACOPP renforcé. 5
Références
1 Early PET Response Adapted Treatment in Stage I-II Hodgkin Lymphoma: Final Results of the Randomized EORTC/LYSA/FIL H10 Trial. André M, Girinsky T, Federico M, et al. J Clin Oncol. 2017
2 Gallamini A, Rossi A, Patti C, et al. Interim PET-adapted chemotherapy in advanced Hodgkin lymphoma (HL): results of the second interim analysis of the Italian GITIL/FIL HD0607 Trial. Hematol Oncol 2015; 33s: 163. Abstract.
3 Press OW, Li H, Schöder H, et al. US intergroup trial of response-adapted therapy for stage III to IV Hodgkin lymphoma using early interim Fluorodeoxyglucose-positron emission tomography imaging: Southwest Oncology Group S0816. J Clin Oncol 2016 Jun 10;34(17):2020-7.
4 Johnson P, Federico M, Kirkwood A, et al. Adapted treatment guides by interim PET-CT scam in advanced Hodgkin’s lymphoma. N Engl J Med 2016 374;25:2419-29.
5 Casasnovas O, Brice P, Bouabdallah R, et al. Randomized Phase III Study Comparing an Early PET Driven Treatment De-Escalation to a Not PET-Monitored Strategy in Patients with Advanced Stages Hodgkin lymphoma : Interim Analysis of the AHL2011 Lysa Study. Blood 126:577 abstract.
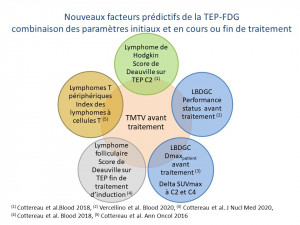
Le volume métabolique total : une nouvelle approche de l’évaluation de la masse tumorale
L’imagerie fonctionnelle permet d’évaluer le volume de la partie la plus active de la tumeur, la somme du volume de chaque lésion tumorale individuelle correspondant au volume métabolique total (VMT). Le VMT évalué sur la TEP initiale, influence le pronostic des patients atteints de lymphome de Hodgkin classique,1, 2, 3 lymphome diffus à grandes cellules B,4, 5 lymphome folliculaire6 et lymphome T périphérique.7, 8 Sa valeur pronostique est supérieure à celle de la mesure de la taille de la plus grosse masse. Il a en outre été montré que le VMT combiné au statut de performance selon l’ECOG permettait au moment du diagnostic de prédire la survie sans progression et la survie globale des patients ayant un lymphome diffus à grandes cellules B quelle que soit leur classe d’âge.9 De manière intéressante, le VMT apporte une information pronostique indépendante de la réponse précoce à la fois dans le lymphome de Hodgkin et le lymphome diffus à grandes cellules B ; la combinaison du VMT et des résultats de la TEP précoce permettent une meilleure stratification des patients à haut risque d’échec thérapeutique. Le VMT est aussi un facteur pronostique important dans les lymphomes diffus à grandes cellules B en rechute avant la réalisation d’une immunothérapie par CAR T-cell anti CD19 et permet de prédire en combinaison avec le nombre de localisations extranodales et le taux de CRP le risque de rechute et de décès après CAR T-cell.10 La technique de calcul du VMT n’est pour le moment pas encore réalisée en routine, mais le développement de logiciels de segmentation semi- automatique des lésions tumorales devrait permettre de diffuser cette technique au-delà des centres pionniers.11,12
Références
1Kanoun S, Rossi C, Berriolo-Riedinger A, et al. Baseline metabolic tumour volume is an independent prognostic factor in Hodgkin lymphoma. Eur J Nucl Med Imaging. 2014 Sep;41(9):1735-43.
2Kanoun S, Tal I, Berriolo-Riedinger A, et al. Influence of Software Tool and Methodological Aspects of Total Metabolic Tumor Volume Calculation on Baseline [18F]FDG PET to Predict Survival in Hodgkin Lymphoma. PloS One. 2015 Oct 16;10(10):e0140830.
3Casasnovas RO, Kanoun S, Tal I, et al. Baseline total metabolic volume (TMTV) to predict the outcome of patients with advanced Hodgkin lymphoma (HL) enrolled in the AHL2011 LYSA trial. J Clin Oncol 34, 2016 (suppl; abstr 7509)
4Sasanelli M, Meignan M, Haioun C, et al. Pretherapy metabolic tumour volume is an independent predictor of outcome in patients with diffuse large B-cell lymphoma. Eur J Nucl Med Mol Imaging. 2014 Nov;41(11):2017-22.
5Casasnovas RO et al. Baseline total metabolic volume (TMTV0) predicts the outcome of patients with DLBCL enrolled in the LNH07-3B LYSA trial. ICML 2015 Hematology and Oncology vol 13 supplement 9, Abstract 83.
6Meignan M, Cottereau AS, Versari A, et al. Baseline Metabolic Tumor Volume Predicts Outcome in High-Tumor-Burden Follicular Lymphoma: A Pooled Analysis of Three Multicenter Studies. J Clin Oncol. 2016 Aug 22. pii: JCO669440. [Epub ahead of print].
7Cottereau AS, Becker S, Broussais F, et al. Prognostic value of baseline total metabolic tumor volume (TMTV0) measured on FDG-PET/CT in patients with peripheral T-cell lymphoma (PTCL). Ann Oncol. 2016 Apr;27(4):719-24.
8Cottereau AS, Hapdey S, Chartier L, et al. Baseline Total Metabolic Tumor Volume measured with fixed or different adaptive thresholding methods equally predicts outcome in Peripheral T cell lymphoma. J Nucl Med. 2016 Oct 6. pii: jnumed. 116. 180406. [Epub ahead of print]
9Vercellino L, Cottereau AS, Casasnovas O, et al. High total metabolic tumor volume at baseline predicts survival independent of response to therapy. Blood 2020 Apr 16;135(16):1396-1405.
10Vercellino L, Di Blasi R, Kanoun S, et al. Predictive factors of early progression after CAR-T cell therapy in relapsed/refractory diffuse large B-cell lymphoma. Blood Adv. 2020 Nov 24;4(22):5607-5615.
11Blanc-Durand P, Jégou S, Kanoun S, et al. Fully automatic segmentation of diffuse large B cell lymphoma lesions on 3D FDG-PET/CT for total metabolic tumor volume prediction using a convolutional neural network. Eur J Nucl Med Mol Imaging2020 Oct 24
12Capobianco N, Meignan M, Cottereau AS, et al. Deep-learning 18FDG Uptake Classification Enables Total Metabolic Tumor Volume Estimation in Diffuse Large B-Cell Lymphoma. J Nucl Med. 2021 Jan;62(1):30-36.
La distance maximale entre les 2 lésions les plus éloignées (SDmax): une nouvelle approche de l’évaluation de la dissémination de la maladie
La distance euclidienne maximale entre les 2 lésions les plus éloignées est un paramètre que l’on peut calculer sur la TEP préthérapeutique.1 Cette distance prédit la survie sans progression et la survie globale des lymphomes diffus à grande cellules B2 et est un facteur pronostique indépendant du VMT. Il reste à évaluer si le PS au diagnostic apporte de l’information pronostique à la combinaison SDmax-VMT et comment se décline la réponse au traitement dans ces différents sous-groupes de risque préthérapeutiques.
Références
1Cottereau AS, Meignan M, Nioche C, et al. Risk stratification in diffuse large B-cell lymphoma using dissemination and metabolic tumor burden calculated from baseline PET/CT0. Ann Oncol. 2020 Mar;32(3):404-411.
2Cottereau AS, Nioche C, Dirand AS, et al. (18)F-FDG PET Dissemination Features in Diffuse Larg B-Cell Lymphoma Are Predictive of Outcome. J Nucl Med. 2020 Jan;61(1):40-45.
Critères de Deauville
Les critères de Deauville sont une évaluation visuelle des lésions résiduelles quelle que soit leur taille, par rapport à un organe de référence, le médiastin et le foie. La lecture est faite sur une échelle en 5 points. La quantification du SUV de la lésion résiduelle avec un organe de référence permet une évaluation plus précise que la seule lecture visuelle.
Score 1 : pas de fixation
Score 2 : fixation ≤ médiastin
Score 3 : fixation > médiastin mais ≤ foie
Score 4 : fixation > foie
Score 5 : fixation >> foie et/ou progression
Les critères sont utilisés pour les évaluations intermédiaires et de fin de traitement, en comparaison avec la TEP avant traitement.
Les scores 1, 2, 3 correspondent à une réponse métabolique complète, RMC.
Les scores 4, 5 avec diminution de l’intensité de fixation des lésions résiduelles correspondent à une réponse métabolique partielle
Les scores 4, 5 avec fixation inchangée (non réponse métabolique) ou augmentée (progression métabolique) et l’apparition de nouvelles lésions hyper-métaboliques sont considérés comme des échecs thérapeutiques.
En fin de traitement, une réponse métabolique partielle est considérée comme une maladie résiduelle.
Les critères de Deauville sont utilisés pour tous les lymphomes avides de FDG, dans les soins courants et les essais cliniques. Ils sont intégrés dans la classification de Lugano 2014 [Cheson 2014].
Volume métabolique tumoral total TMTV
Le volume métabolique tumoral total (TMTV) est obtenu en additionnant le volume métabolique de chacune des lésions ganglionnaires et extra-ganglionnaires.
Les méthodes de mesures du TMTV ne sont pas encore standardisées, un logiciel permettant une mesure tridimensionnelle des masses hyper-métaboliques est en cours de développement. Une harmonisation des méthodes de mesure et une définition des seuils selon le type de lymphome sont nécessaires et en cours.
La valeur prédictive du TMTV pour la survie sans progression est confirmée pour plusieurs lymphomes : lymphomes B diffus à grandes cellules, lymphome de Hodgkin, lymphome primitif du médiastin, lymphome folliculaire, lymphome à cellules du manteau, lymphomes T périphériques [Meignan 2021, Vercellino 2020,Cottereau Blood 2018, Meignan 2016, Cottereau J Nucl Med 2018]. Le développement du TMTV dans les essais cliniques devrait lui donner une place importante pour stratifier les groupes de risque, définir de nouveaux index pronostiques, guider la stratégie thérapeutique de plusieurs lymphomes dans le cadre des essais cliniques. Dans les index pronostiques, le TMTV ne remplace pas encore l’atteinte volumineuse définie selon les critères classiques. Le TMTV permet de guider le traitement du lymphome de Hodgkin et des lymphomes B diffus à grandes cellules, mais son utilisation n’est pas recommandée en dehors des essais cliniques pour les autres lymphomes.
Delta SUVmax
SUVmax de la lésion la plus intense de la TEP initiale moins SUVmax de la lésion la plus intense de la TEP intermédiaire, même si elle ne correspond pas à la lésion initiale. Le delta SUVmax a une valeur pronostique pour la survie sans progression des lymphomes B diffus à grandes cellules et du lymphome de Hodgkin classique [Itti 2013, Casasnovas 2011]. Il est utilisé en pratique seulement pour guider le traitement des lymphomes B diffus à grandes cellules [Casasnovas 2017, Le Gouill 2021].
Dmaxpatient
Distance maximum entre les 2 lésions hyper-métaboliques les plus distantes, mesurée sur la TEP avant traitement.
La Dmaxpatient est évaluée pour les lymphomes B diffus à grandes cellules. Elle a une valeur prédictive pour la survie sans progression et la survie globale [Cottereau 2021].
Le TMTV est un des paramètres les plus prometteurs pour les lymphomes B diffus à grandes cellules. L’influence du TMTV sur la pharmacocinétique du rituximab a été rapportée [Tout 2017], de même que sa corrélation avec l’ADN tumoral circulant [Kurtz 2018]. Les liens entre TMTV, pharmacocinétique des médicaments et réponse au traitement sont des voies de recherche pour un rapport bénéfice risque optimal du traitement.
Barrington SF, Mikhaeel NG, Kostakoglu L, et al. Role of imaging in the staging and response assessment of lymphoma: consensus of the International Conference on Malignant Lymphomas Imaging Working Group. J Clin Oncol 2014; 32: 3048–58.
Barrington SF, Trotman J. The role of PET in the first-line treatment of the most common subtypes of non-Hodgkin lymphoma. Lancet Haematol 2021;8: e80-93.
Casasnovas RO, Meignan M, Berriolo-Riedinger A, et al. SUVmax reduction improves early prognosis value of interim positron emission tomography scans in diffuse large B-cell lymphoma. Blood 2011 Jul 7;118(1):37-43.
Casasnovas RO, Ysebaert L, Thieblemont C, et al. FDG-PET driven consolidation strategy in diffuse large B-cell lymphoma: final results of a randomized phase 2 study. Blood 2017 Sep 14;130(11):1315-1326.
Cheson BD, Pfistner B, Juweid ME, et al. Revised response criteria for malignant lymphoma. J Clin Oncol. 2007;25:579-586.
Cheson BD, Fisher RI, Barrington SF, Cavalli F, Schwartz LH, Zucca E, Lister TA. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. J Clin Oncol. 2014 Sep 20;32(27):3059-68.
Cottereau AS, Versari A, Loft A, et al. Prognostic value of baseline metabolic tumor volume in early-stage Hodgkin lymphoma in the standard arm of the H10 trial. Blood. 2018 Mar 29;131(13):1456-1463.
Cottereau AS, El-Galaly TC, Becker S, et al. Predictive value of PET response combined with baseline metabolic tumor volume in peripheral T-cell lymphoma patients. J Nucl Med. 2018 Apr;59(4):589-595.
Cottereau AS, Meignan M, Nioche C, et al. Risk stratification in diffuse large B cell lymphoma using lesion disseminated and metabolic tumor burden calculated from baseline PET/CT. Ann Oncol. 2021 Mar;32(3):404-411.
Dickinson M, Hoyt R, Roberts AW, et al. Improved survival for relapsed diffuse large B cell lymphoma is predicted by a negative pre-transplant FDG-PET scan following salvage chemotherapy. Br J Haematol. 2010;150(1):39-45.
Itti E, Meignan M, Berriolo-Riedinger A, et al. An international confirmatory study of the prognostic value of early PET/CT in diffuse large B-cell lymphoma: comparaison between Deauvillle criteria and ΔSUVmax. Eur J Nucl Med Mol Imaging. 2013 Sep;40(9):1312-20.
Juweid ME, Stroobants S, Hoekstra OS, et al. Use of positron emission tomography for response assessment of lymphoma: consensus of the Imaging Subcommittee of International Harmonization Project in Lymphoma. J Clin Oncol 2007; 25: 571–78.
Kurt DM, Scherer F, Jin MC, et al. Circulating Tumor DNA Measurements as early outcome predictors in diffuse large B-cell lymphoma. J Clin Oncol. 2018 Oct 1;36(28):2845-2853.
Le Gouill S, Ghesquières H, Oberic L, et al. Obinutuzumab vs rituximab for advanced DLBCL:aPET guided and randomized phase 3 by LYSA. Blood 2021 Apr 29;137(17):2307-2320.
Meignan M, Cottereau AS, Versari A, et al. Baseline metabolic tumor volume predicts outcome in high-tumor burden follicular lymphoma: A pooled analysis of three multicenter studies. J Clin Oncol. 2016;34(30):3618-3626.
Meignan M, Cottereau AS, Specht L, Mikhaeel NG. Total tumor burden in lymphoma – an evolving strong prognostic parameter. Br J Radiol 2021;94:20210448.
Noring K, Carlsten M, Sonnevi K, Wahlin BE. The value of complete remission according to positron emission tomography prior to autologous stem cell transplantation in lymphoma: a population-base study showing improved outcome. BMC Cancer. 2021 May 4;21(1):500.
Peignaux-Casasnovas K, Truc G, Rossi C, Casasnovas O. Role of radiotherapy in haematology. Cancer Radiother. 2021 Oct;25(6-7):603-606.
Spaepen K, Stroobants S, Dupont P, et al. Prognostic value of pretransplantation positron emission tomography using fluorine 18-fluorodeoxyglucose in patients with aggressive lymphoma treated with high-dose chemotherapy and stem cell transplantation. Blood. 2003 Jul 1;102(1):53-9.
Tout M, Casasnovas O, Meignan M, et al. Rituximab exposure is influenced by baseline metabolic tumor volume and predicts outcome of DLBCL patients: a Lymphoma Study Association report. Blood. 2017 May 11;129(19):2616-2623.
Trotman J, Barrington S. The role of PET in first-line treatment of Hodgkin lymphoma. Lancet Haematol 2021; 8: e67-79.
Vercellino L, Di Blasi, Kanoun S, et al. Predictive factors of early progression after CAR T-cell therapy in relapsed/refractory diffuse large B-cell lymphoma. Blood Adv 2020 Nov 24;4(22):5607-5615.
Vercellino L, Cottereau AS, Casasnovas, et al. High total metabolic tumor volume at baseline predicts survival independent of response to therapy. Blood. 2020;135(16):1396-1405.
