Cellules CAR-T
Les indications de cellules CAR-T CD19 dans les lymphomes B s’élargissent depuis quelques mois sur la base de nouvelles études.
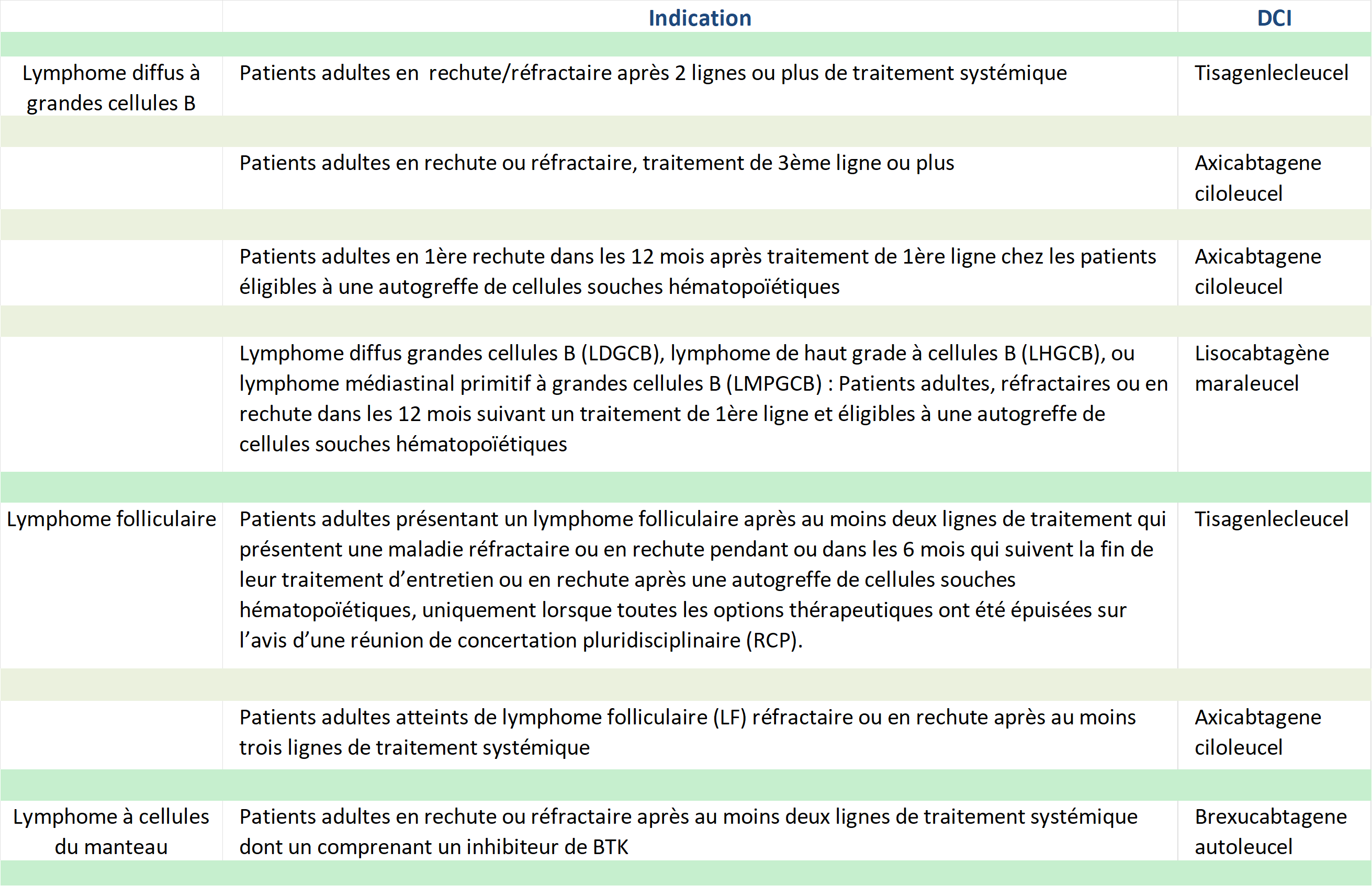
Dans le lymphome diffus à grandes cellules B, l’indication AMM après échec de 2 lignes thérapeutiques (Tisa-cel, Axi-cel) a été complétée par une nouvelle indication en 1ere rechute dans les 12 mois après traitement de 1ere ligne chez les patients éligibles à une autogreffe de cellules souches hématopoïétiques (Accès précoce). Deux essais de phase III (Zuma-7 et Transform) ont en effet montré la supériorité en termes de survie sans progression des cellules CAR-T (respectivement Axi-cel et Liso-cel) comparé au traitement standard, immuno-chimiothérapie suivie d’autogreffe de cellules souches hématopoïétiques (Bishop MR et al. N Engl J Med 2022, Kamdar M et al. Lancet 2022).
Dans le lymphome folliculaire, un accès précoce en 3ème ligne (Tisa-cel) ou 4eme ligne (Axi-cel) ont également été obtenus depuis la fin 2021 sur la base de 2 études de phase 2 (Elara: Fowler N et al. Nat Med 2022, et Zuma-5: Jacobson C et al. Blood 2020 et Lancet Oncol 2022).
Dans le lymphome à cellules du manteau, il existe une indication AMM en 3ème ligne thérapeutique (Brexu-cel) après échec d’un inhibiteur de BTK. Les résultats de l’étude pivotale Zuma-2 mise à jour avec un suivi médian de 3 ans, confirment qu’il s’agit de la meilleure option thérapeutique après échec de 2 lignes de traitement (Wang M et al, N Engl J Med 2020 et J Clin Oncol 2022).
Il est important de souligner que les études des cellules CAR-T en situation de « vraie vie » montrent une efficacité et une toxicité similaire à celle décrite dans les études pivotales et ceci quelle que soit la molécule considérée (Bachy E et al. Nat Medicine 2022; Iacoboni G et al. Cancer Med 2021 et Blood adv 2022).
Les cellules CAR-T (Chimeric Antigen Receptor T) sont des lymphocytes T transformés pour identifier et détruire des cellules étrangères à l’organisme et en particulier cancéreuses. Cette modification génique faite par un laboratoire pharmaceutique leur confère le statut de médicament. De ce fait, ces médicaments sont classés en médicament de thérapie innovante ou MTI et plus spécifiquement en thérapie génique. Les CARs sont des récepteurs avec un domaine extracellulaire spécifique de l’antigène cible (chaine protéique issue de la part variable d’une chaine lourde et une chaine légère) et un domaine intracellulaire (comportant le récepteur des lymphocytes T et des molécules de co-stimulation), ayant pour but d’activer le lymphocyte contre les cellules cibles à détruire. Les cellules porteuses du CAR ne sont pas liées au Complexe Majeur d’Histocompatibilité (CMH) pour leur reconnaissance antigénique. Le gène codant pour le CAR est introduit dans la cellule à l’aide d’un vecteur viral. Puis ces cellules modifiées doivent faire l’objet d’une expansion in vitro. Cette phase de production dure 2 à 3 semaines. Elles sont ensuite injectées au patient après une courte chimiothérapie de lymphodéplétion.
Elles sont actuellement autologues, mais il existe déjà des CART allogéniques en essais cliniques.
Les premiers médicaments ciblent le CD 19, antigène présent sur la plupart des cellules B, et donc indiqués dans le traitement des LAL et des LNH en rechute ou réfractaires, mais depuis des CAR-T ciblant le BCMA (B Cell Maturation Antigen) vont pouvoir être administrés via une autorisation d’accès précoce (AAP) dans le traitement du myélome en rechute.
L’Agence européenne a maintenant autorisé quatre médicaments dans le traitement d’hémopathies. Le tisagenlecleucel ou KYMRIAH® du laboratoire NOVARTIS, l’axicabtagene ciloleucel ou YESCARTA® du laboratoire GILEAD, le brexucabtagene autoleucel ou TECARTUS® des laboratoires Gilead. Un quatrième médicament est disponible avec le dispositif d’autorisation en accès précoce, le Lisocabtagène maraleucel ou BREYANZI® du laboratoire BMS dans le traitement du lymphome diffus à grandes cellules B en rechute ou réfractaire.

Depuis mi 2018, les CAR-T (Chimeric Antigen Receptor) T cells sont de plus en plus prescrits et administrés en France. C’est aujourd’hui près de 40 centres répartis sur tout le territoire qui peuvent proposer à leurs patients ces traitements innovants. La prise en charge par transfert des patients est organisée entre les centres traitants et les centres adresseurs. Les centres prescripteurs doivent être autorisés par leur ARS à l’administration de ces médicaments.
En effet, ces médicaments nécessitent une organisation logistique très spécifique (aphérèse, traitement des cellules prélevées avec exportation pour transformation et expansion puis retour du médicament avec stockage dans des cuves à azote liquide). Le service clinique prenant en charge le patient doit être autorisé à pratiquer des greffes et une réanimation est nécessaire pour traiter les syndromes de relargage des cytokines et les toxicités neurologiques (ICANS: Immune effector cell-associated neurotoxicity syndrome). La procédure d’administration et de gestion des cellules CART nécessite des moyens équivalents à ceux d’une greffe.
Les résultats cliniques de ces médicaments pour des maladies réfractaires sont très intéressants avec un taux de réponse objective d’environ 80 % et des réponses complètes dans près de 40 à 60 % des cas, en fonction des études et des types de lymphomes. Avec un recul de plus de 5 ans dans les études lymphomes, un patient sur 2 est encore en réponse.
D’excellents résultats ont été publiés dans les lymphomes folliculaires en traitement au-delà de la 3ème ligne, ainsi que dans différents types de lymphomes plus rares.
La gestion des effets indésirables s’est améliorée. Les équipes maîtrisent de mieux en mieux l’apparition de syndrome de relargage des cytokines (CRS). Il en est de même des toxicités neurologiques.
Malgré ces avancées, il reste de nombreuses questions à résoudre:
Sur le plan de la fabrication, les délais de près d’un mois nécessaires à la transformation et l’expansion des cellules modifiées peuvent être délétères chez certains patients. Un raccourcissement de cette mise à disposition est indispensable. Elle n’est que partiellement améliorée par des usines de fabrication situées en Europe. Plus intéressant, les laboratoires mettent au point des formes de cellules CAR-T plus faciles à fabriquer ou déjà pré-préparées comme les CAR-T allogéniques. Des cellules prélevées par leukaphérèse de manière anticipée peuvent être congelées et utilisées avec certains médicaments.
Sur le plan de l’hospitalisation, un raccourcissement de la durée de séjour peut être envisagé. Des études sont menées aux USA pour des injections en ambulatoire, avec retour en hospitalisation dès les premiers signes d’effets indésirables.
Sur le plan des toxicités, il faut définir des facteurs pronostiques notamment pour l’apparition des formes sévères: l’âge, la dose et le type de médicament, la composition cellulaire du médicament, le type de lymphodéplétion, la taille de la tumeur ou le taux de LDH et l’expansion ou non des cellules CAR-T sont des facteurs qui sont analysés.
Sur le plan pharmacologique, l’utilisation des cellules NK au lieu des lymphocytes T semblent améliorer la persistance et l’expansion. Les laboratoires ont déjà fabriqué des CAR-T bi-spécifiques ciblant à la fois le CD 19 mais aussi le CD20.
Abramson JS, Palomba ML, Gordon LI, et al. Lisocabtagene maraleucel for patients with relapsed or refractory large B-cell lymphomas (TRANSCEND NHL001): a multicentre seamless design study. Lancet 2020 Sep 19;396(10254):839-852. Doi:10.1016/S0140-6736(20)31366-0. Epub 2020Sep 1.
Bachy E, Le Gouill S, Di Blasi R, et al. A real world comparison of tisagenlecleusel and axicabtagene Ciloleucel CAR T cells in relapsed or refractory diffuse large B cell lymphoma. Nat Med. 2022 Oct;28(10):2145-2154. Doi:10.1038/s41591-022-01969-y. Epub 2022 Sep 22.
Bishop MR, Dickinson M, Purtill D, et al. Second-line Tisagenlecleucel or standard care in aggressive B-cell lymphoma. N Engl J Med 2022 Feb 17;386(7):629-639. Doi: 10.1056/NEJMoa2116596.
Brudno JN, Kochenderfer JN. Chimeric antigen receptor T-cell therapies for lymphoma. Nat Rev Clin Oncol 2018 jan;15(1):31–46.
Denlinger N, Bond D, Jaglowski S. CAR T-cell therapy for B-cell lymphoma. Curr Probl Cancer 2022 February; 46(1):100826.
Fowler NH, Dickinson M, Dreyling M, et al. Tisagenlecleucel in adult relapsed or refractory follicular lymphoma: the phase 2 ELARA trial. Nat Med 2022 Feb;28(2):325-332. Doi: 10.1038/s41591-021-01622-0. Epub 2021 Dec 17.
Iacoboni G, Villacampa G, Martinez-Cibrian N, et al. Real-world evidence of tisagenlecleucel for the treatment of relapsed or refractory large B-cell lymphoma. Cancer Med 2021;10(10):3214-3223.
Iacobini G, Rejeski K, Villacampa G, et al. Real-world evidence of brexucabtagene autoleucel for the treatment of relapsed or refractory mantle cell lymphoma. Blood Adv 2022 Jun 28;6(12):3606-3610. Doi: 10.1182/bloodadvances.2021006922
Jacobson C, Chavez JC, Sehgal AR, et al. Primary analysis of Zuma-5 : a phase 2 study of Axicabtagene Ciloleucel (axi-cel) in patients with relapsed/refractory (R/R) indolent non-Hodgkin lymphoma (iNHL). Blood 2020;136(suppl 1):40-41.
Jacobson CA, Chavez JC, Sehgal AR, et al. Axicabtagene Ciloleucel in relapsed or refractory indolent non-Hodgkin lymphoma (ZUMA-5): a single-arm, multicentre, phase 2 trial. Lancet oncol 2022;23:91-103.
Kamdar M, Solomon SR, Arnason J, et al. Lisocabtagene maraleucel versus standard of care with salvage chemotherapy followed by autologous stem cell transplantation as second-line treatment in patients with relapsedor refractory large B-cell lymphoma (TRANSFORM): results from an interim analysis of an open-label, randomized, phase 3 trial. Lancet 2022;399:2294-308.
Locke FL, Miklos DB, Jacobson CA, et al. Axicabtagene Ciloleucel as second-line therapy for large B cell lymphoma. New Engl J Med 2022;386:640-54.
Neelapu SS, Locke FL, Bartlett NL, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. N Engl J Med 2017 Dec 28;377(26):2531-44.
Schuster SJ, Svoboda J, Chong EA, et al. Chimeric Antigen Receptor T Cells in Refractory B-Cell Lymphomas. N Engl J Med. 2017 Dec 28;377(26):2545-54.
Wang M, Munoz J, Goy A, et al. KTE-X19 CAR T-Cell Therapy in Relapsed or Refractory Mantle-Cell Lymphoma. N Engl J Med. 2020 Apr 2;382(14):1331-1342.doi: 10.1056/NEJMoa1914347
Wang M, Munoz J, Goy A, et al. Three-year follow-up of KTE-X19 in patients with relapsed/refractory mantle cell lymphoma, including high-risk subgroups, in the ZUMA-2 study. J Clin Oncol 2022 Jun 4;JCO2102370/ doi: 10.1200/JCO.21.02370.
RCP Kymriah : https://www.ema.europa.eu/en/documents/product-information/kymriah-epar-product-information_fr.pdf
RCP Yescarta : https://www.ema.europa.eu/en/documents/product-information/yescarta-epar-product-information_fr.pdf
RCP Tecartus : https://www.ema.europa.eu/en/documents/product-information/tecartus-epar-product-information_en.pdf
Breyanzi Autorisation d’accès précoce (AAP) : https://ansm.sante.fr/tableau-acces-derogatoire/breyanzi