L’objectif du traitement initial est d’obtenir une réponse complète après 4 cycles de l’association anticorps anti-CD20 et chimiothérapie ; le rituximab est l’anticorps monoclonal de référence. Le traitement de consolidation a pour objectif de maintenir ou d’obtenir une rémission complète en fin de traitement et de réduire le risque de rechute – progression.
Critères de choix :
Index pronostique international ajusté à l’âge (IPIaa) et/ou essai thérapeutique
Présentation clinique
Volume tumoral important
Lymphome à grandes cellules B primitif du médiastin
Phénotype ABC ou non GC
4 modalités les plus courantes
R-CHOP-21 (intervalle 20 jours): traitement standard
R-CHOP-14 (intervalle 14 jours): situations similaires aux indications de l’ACVBP
R-mini-CHOP
R-ACVBP: patients jeunes, lymphome type ABC ou non GC, lymphome à grandes cellules B primitif du médiastin
Une étude a montré la supériorité de pola-R-CHP (polatuzumab vedotin, rituximab, cyclophosphamide, doxorubicin, prednisone) sur R-CHOP en termes de survie sans progression [Tilly NEJM 2022]. Mais le polatuzumab n’est pas retenue par les autorités en France.
Traitement de consolidation
Le traitement de consolidation est défini soit selon l’IPIaa et confirmé par l’obtention de la réponse complète après traitement initial, soit guidé par la réponse au traitement initial, évaluée par le TEP scanner après 2 et 4 cycles.
Critères de choix :
IPIaa et/ou essai thérapeutique.
Réponse au traitement initial :
Une réponse complète confirme la consolidation définie selon l’IPIaa pour les patients jeunes (< 61ans).
Une réponse partielle à 4 cycles peut nécessiter une documentation par biopsie selon le bénéfice-risque pour définir le traitement le plus adapté.
Une maladie stable ou une progression à 4 cycles ne permet pas de confirmer la consolidation initialement prévue, et nécessite un traitement de 2ème ligne.
Modalités les plus courantes
- Identique au traitement initial : R-CHOP-21, R-CHOP-14 ou R-mini-CHOP
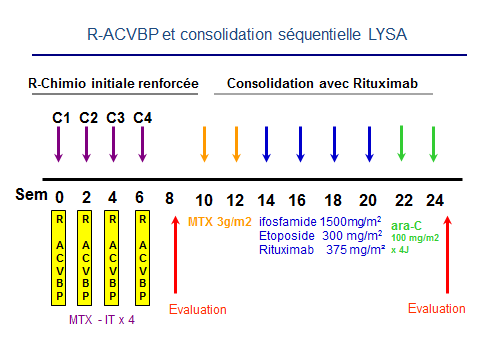
- Consolidation séquentielle du LYSA avec rituximab, après R-ACVBP
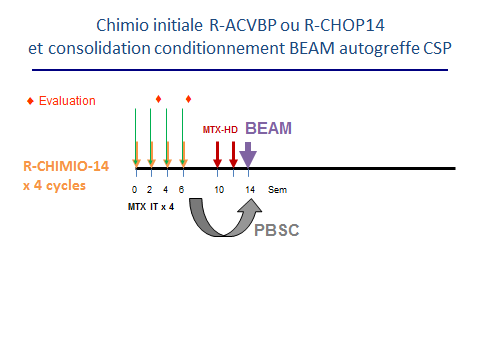
- Intensification thérapeutique avec conditionnement BEAM et autogreffe de cellules souches selon l’essai GAINED. Une intensification suivie d’autogreffe a pratiquement disparue et ne concerne qu’ environ 10% des patients.
Traitement d’entretien
Un traitement de maintenance par Rituximab n’a pas montré de bénéfice en termes de contrôle de la maladie [Habermann JCO 2006, Jaeger Haematologica 2015].
Un traitement d’entretien par Lenalidomide chez les patients en rémission complète après R-CHOP n’est pas recommandé. L’essai REMARC comparant Lenalidomide versus placebo a montré une amélioration de la survie sans progression, mais l’absence de bénéfice de survie [Thieblemeont J Clin Oncol 2017].
Une méta-analyse conclut à l’absence de bénéfice en termes de survie de différents traitements de maintenance après immunochimiothérapie de 1ère ligne [Yuan Ther Adv Hematol 2021].
| Groupes de risque | ||
| Avec traitement guidé par TEP | Essai LYSA | |
| Patients âgés 18-80 ans, stades localisés, IPIaa = 0 | LNH 09-1B | |
| Patients âgés 18 – 60 ans, IPIaa = 1 – 3 (1) | GAINED | |
| Sans traitement guidé par TEP | ||
| Patients âgés de 60 à 80 ans avec IPIaa >0 | ||
| Patients âgés de plus de 80 ans |
(1) Possible jusqu’à 65 ans si patient en bon état général, sans comorbidité
Après R-CHOP-21, traitement guidé par TEP-scan selon essai LNH09-1B LYSA
TEP 2 négative et TEP 4 négative : arrêt de traitement, total R-CHOP x 4
TEP 2 positive et TEP 4 négative : R-CHOP x 2 cycles supplémentaires, total R-CHOP x 6.

L’étude LNH09-1B LYSA, pour les patients âgés 18 -80 ans, atteints d’un stade localisé sans facteur de risque, a confirmé un nouveau traitement standard par R-CHOP x 4 cycles si TEP négative après 2 et 4 cycles et R-CHOP x 6 cycles si TEP positive après 2 cycles et négative après 4 cycles. L’analyse finale de l’essai LNH09-1B LYSA a montré avec un suivi médian de 5 ans, la non infériorité de 4 RCHOP 21 versus 6, en termes de survie sans progression [Bologna, en attente de publication].
Traitement selon essai GAINED – LYSA , R-chimio14 : R-CHOP14 ou R-ACVBP.
Selon la réponse consolidation séquentielle LYSA avec Rituximab ou consolidation par intensification thérapeutique avec ASCT
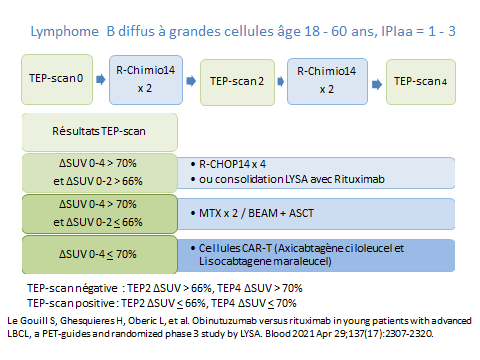
L’essai GAINED a montré l’absence de supériorité de l’obinituzumab comparé au Rituximab en combinaison avec une chimiothérapie d’induction de type CHOP14 ou ACVBP suivi d’une consolidation thérapeutique TEP guidée. Le standard de traitement d’induction reste donc R-chimiothérapie dans cette population. Cette étude montre aussi que le pronostic des patients TEP2/4- négatif qui recevaient une consolidation par immuno-chimiothérapie standard est excellent en termes de survie sans progression et de survie globale. La consolidation par chimiothérapie haute dose et autogreffe de cellules souches hématopoïétiques chez les patients TEP2+/TEP4- permet de reverser le mauvais pronostic des patients TEP2+ recevant une consolidation standard. Ainsi dans l’essai GAINED patients TEP2+/4- et TEP2-/4- ont une survie sans progression et globale similaire. Enfin les patients TEP4+ doivent être considérés en échec du traitement d’induction et proposés pour un traitement par cellules CAR-T (Axicabtagène ciloleucel et Lisocabtagene maraleucel ).
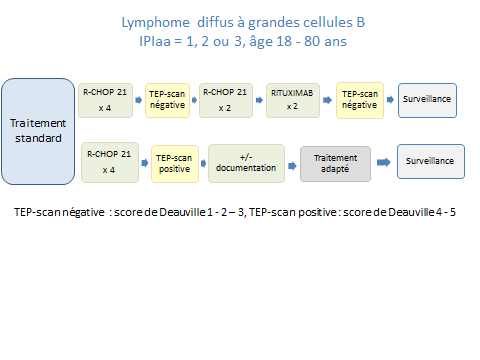
R-CHOP-21 x 4 cycles
- TEP 4 négative : R-CHOP-21 x 2 cycles (total R-CHOP x 6 cycles) + Rituximab x 2
- TEP 4 positive, réponse partielle : +/- documentation et traitement adapté
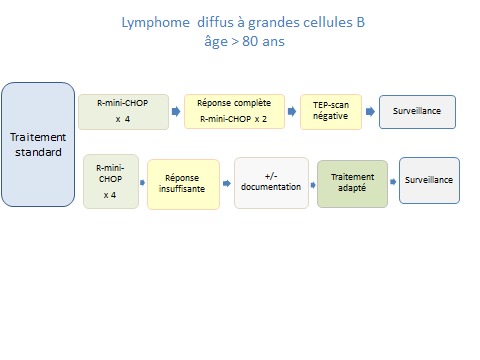
Chez les patients à partir de 80 ans, une pré-phase est possible et recommandée si PS >= 2
Vincristine 1 mg dose totale à J-7 + corticoïdes de J-7 à J0
R-mini-CHOP x 4 cycles
Réponse complète: consolidation R-mini-CHOP x 2 cycles
Réponse insuffisante ou progression : traitement de2ème ligne
- TEP 2 négative et TEP 4 négative
- TEP 2 positive et TEP 4 négative
Obinutuzumab
2 études n’ont pas montré de supériorité du GA101 par rapport au rituximab.
L’essai GOYA, dont l’objectif principal était de comparer Obinutuzumab-CHOP à R-CHOP chez les patients avec un IPI > ou = 2, montrait une survie sans progression et une survie globale à 3 ans identiques dans le groupe 6 R-CHOP + 2 R versus 8 R-CHOP [Vitolo U, et al. J Clin Oncol 2017].
L’étude GAINED n’a pas atteint l’objectif primaire : le GA101 n’améliore pas l’EFS, PFS, OS comparé au rituximab malgré un surcroît de toxicité [Le Gouill Blood 2021].
Polatuzumab vedotin
L’essai POLARIX a comparé polatuzumab vedotin à la place de vincristine, associé à R-CHP versus placebo-R-CHOP chez les patients âgés de 18 à 80 ans atteints d’un LDGCB de risque intermédiaire et haut risque. Le traitement Pola-R-CHOP améliore la survie sans progression [Tilly H, N Engl J Med 2021].
Décembre 2022, avis défavorable de la HAS au remboursement de POLIVY (polatuzumab vedotin) en association avec le rituximab, le cyclophosphamide, la doxorubicin et la prednisone dans le traitement des patients adultes atteints d’un lymphome diffus à grandes cellules B non précédemment traité.
AMM en France mais pas de remboursement et non commercialisé en France.
Ibrutinib
L’essai randomisé de phase III PHOENIX a comparé Ibrutinib-R-CHOP à placebo-R-CHOP chez les patients atteints de lymphome diffus à grandes cellules B de type ABC. L’objectif primaire, survie sans événement en intention de traitement ou pour le sous-groupe ABC n’a pas été atteint. Avant 60 ans Ibrutinib-R-CHOP améliore la survie sans événement, la survie sans progression et la survie globale, avec une toxicité gérable. Après 60 ans l’ibrutinib plus R-CHOP est associé à une toxicité accrue qui limite l’administration du R-CHOP avec des résultats moins bons [Younes J Clin Oncol 2019].
D’autres inhibiteurs de BTK (acalabrutinib, zanubrutinib) sont en cours d’évaluation en situation de première ligne de traitement des DLBCL associé au R-CHOP.
Bortezomib
L’essai anglais REMoDL-B de phase 3 comparant l’association bortezomib R-CHOP au R-CHOP n’a pas montré de supériorité en termes de survie sans progression [Davies et al Lancet Oncol 2019].
Les anticorps bispécifiques anti CD20/CD3 sont en cours d’évaluation dans le cadre d’essais de phase 3.
CNS-IPI est utilisé pour évaluer le risque
CNS-IPI sur Lymphoma-Care
Facteurs de risque
Âge > 60 ans
PS > ou = 2
Extranodal > 1
Stade III-IV
LDH élevées
Atteinte rein / surrénale
CNS-IPI (Adapté selon Savage KJ, ASH 2017)
Risque faible (0 – 1 facteur)
Risque de rechute SNC à 2 ans < 1%
Investigations spécifiques non indiquées sauf lymphome testiculaire et autres localisations extra-ganglionnaires.
Risque intermédiaire (2 – 3 facteurs)
Risque de rechute SNC à 2 ans < 5%
Investigations spécifiques (IRM cérébrale / scanner, LCR) indiquées pour lymphome testiculaire, rein, surrénale, utérus ou double hit MYC/BCL2.
Risque élevé (> = 4 facteurs)
Risque de rechute SNC à 2 ans > ou = 10%
Investigations spécifiques (IRM cérébrale / scanner, LCR)indiquées pour tous les patients (âge < 80 ans)
Prophylaxie SNC recommandée en particulier si > 2 atteintes viscérales
Atteinte neuro-méningée initiale
Possible bénéfice de R-CHOP MTX-Haute dose (> 3 g/m²) ou R-COPADEM, malgré l’absence d’étude.
- Bologna S, Vander Borght T, Brière J, et al. Early positron emission tomography response-adapted treatment in localized diffuse large B-cell lymphoma (aaIPI=0) : results of the phase 3 LYSA LNH 09-1B trial. Abstract ICML Lugano 2021 – plenary session – June 19th
- Buske C, Hutchings M, Ladetto M, et al. ESMO Consensus Conference on malignant lymphoma: general perspectives and recommendations for the clinical management of the elderly patient with malignant lymphoma. Ann of Oncol 29:544-562, 2018.
- Casasnovas RO, Ysebaert L, Thieblemont C, Bachy E, Feugier P, Delmer A, et al. FDG-PET-driven consolidation strategy in diffuse large B-cell lymphoma: final results of a randomized phase 2 study. Blood 2017 Sep14;130(11):1315-1326.
- Davies A, Cummin TE, Barrans S, et al. Gene-expression profiling of bortezomib added to standard chemoimmunotherapy for diffuse large B-cell lymphoma (REMoDL-B): an open-label, randomized, phase 3 trial. Lancet Oncol 2019 May;20(5):649-662.
- Dührsen U, Müller S, Hertenstein B, et al. Positron emission tomography-guided therapy of aggressive non-hodgkin lymphomas (PETAL) : A multicenter, randomized phase III trial. J Clin Oncol 2018 36:2024-2034.
- Habermann TM, Weller EA, Morrison VA, et al. Rituximab-CHOP versus CHOP alone or with maintenance rituximab inolder patients with diffuse large B-cell lymphoma. J Clin Oncol. 2006 Jul1;24(19):3121-7.
- Jaeger U, Trneny M, Melzer H, et al. Rituximab maintenance for patients with aggressive B-cell lymphoma in first remission: results of the randomized NHL13 trial. Haematologica 2015 Jul;100 (7):955-63.
- Ketterer N, Coiffier B, Thieblement C, Fermé C, Brière J, Casasnovas O, et al. Phase III study of ACVBP versus ACVBP plus rituximab for patients with localized low-risk diffuse large B-cell lymphoma (LNH03-1B). Ann Oncol. 2013 Apr;24(4):1023-7.
- Lamy T, Damaj G, Soubeyran P, Gyan E, Cartron G, Bouabdallah K, et al. R-CHOP 14 with or without radiotherapy in nonbulky limited-stage diffuse large B-cell lymphoma. Blood 2018 Jan 11;131(2):174-181.
- Le Gouill S, Ghesquières H, Oberic L, et al. Obinutuzumab vs rituximab for advanced DLBCL: a PET-guided and randomized phase 3 study by LYSA. Blood 2021 Apr 29;137(17):2307-2320.
- Molina TJ, Canioni D, Copie-BergmanC, Recher C, Brière J, Haioun C, et al. Young patients with non-germinal center B-cell-like diffuse large B-cell lymphoma benefit from intensified chemotherapy with ACVBP plus rituximab compared with CHOP plus rituximab: analysis of data from the Groupe d’Etudes des Lymphomes de l’Adulte/lymphoma study association phase III trial LNH 03-2B. J Clin Oncol 2014 Dec 10;32(35):3996-4003.
- Persky DO, Li H, Stephens DM, et al. Positron emission tomography-directed therapy for patients with limited-stage diffuse large B-cell lymphoma : Results of intergroup national clinical trials network study S1001. J Clin Oncol 2020, 38:3003-3011.
- Peyrade F, Jardin F, Thieblemont C, et al. Attenuated immunochemotherapy regimen (RminiCHOP) in elderly patients older than 80 years with diffuse large B-cell lymphoma: a multicentre, single-arm, phase 2 trial. Lancet Oncol 2011;12(5):460–468.
- Poeschel V, Held G, Ziepert M, et al. Four versus six cycles of CHOP chemotherapy in combination with six application of rituximab in patients with aggressive B-cell lymphoma with favourable prognosis (FLYER): a randomised, phase 3, non-inferiority trial. Lancet 2019 Dec 21;394(10216):2271-2281.
- Récher C, Coiffier B, Haioun C, et al. Intensified chemotherapy with ACVBP plus rituximab versus standard CHOP plus rituximab for the treatment of diffuse large B-cell lymphoma (LNH03-2B): an open-label randomised phase 3 trial. Lancet 2011;378(9806):1858–1867.
- Thieblemont C, Tilly H, Gomes da Silva M, et al. Lenalidomide maintenance compared with placebo in responding elderly patients with diffuse large B-cell lymphoma treated with first-line Rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone. J Clin Oncol 2017 Aug 1;35(22):2473-2481.
- Tilly H, Gomes da Silva M, Vitolo U, et al. Diffuse large B-cell lymphoma (DLBCL) : ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 26 (Supplement 5):v116-v125, 2015.
- Tilly H, Morschhauser F, Sehn LH, et al. Polatuzumab vedotin in previously untreated diffuse large B-cell lymphoma. N Engl J Med. 2022 Jan 27;386(4):351-363.
- Vitolo U, Trneny M, Belada D, et al. Obinutuzumab or Rituximab Plus Cyclophosphamide, Doxorubicine, Vincristine, and Prednisone in previously untreated diffuse large B-cell lymphoma. J Clin Oncol 2017;35(31):3529-37.
- Younes A, Sehn LH, JohnsonP, et al. Randomised phase III trial of Ibrutinib and rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone in non-germinal center B-celldiffuse large B-cell lymphoma. JClin Oncol 2019 May 20;37(15):1285-1295.
- Yuan T, Zhang F, Yao Q, et al. Maintenance therapy for untreated diffuse large B-cell lymphoma : a systematic review and network meta-analysis. Ther Adv Hematol. 2021 May 29;12:20406207211018894.
CNS-IPI - Schmitz N, Zeynalova S, Nickelsen M, et al. CNS International Prognostic Index: A Risk Model for CNS Relapse in patients with Diffuse Large B-Cell Lymphoma treated with R-CHOP. J Clin Oncol. 2016;34(24):3150-3156.
- Savage KJ. Secondary CNS relapse in diffuse large B-cell lymphoma: defining high-risk patients and optimization of prophylaxis strategies. Hematology Am Soc Hematol Educ Program. 2017 Dec 8;2017(1):578-586.
