Essais cliniques
Les essais cliniques évaluent de nouveaux traitements (médicaments ou associations de médicaments, modalités d’administration, stratégies thérapeutiques).
Ils sont proposés chaque fois que possible au patient dont la participation est libre et volontaire. Les protocoles de recherche clinique sont validés par des comités d’éthique et sont particulièrement encadrés par la législation. Les progrès réalisés et à accomplir reposent sur la recherche clinique et la participation des patients aux essais cliniques.
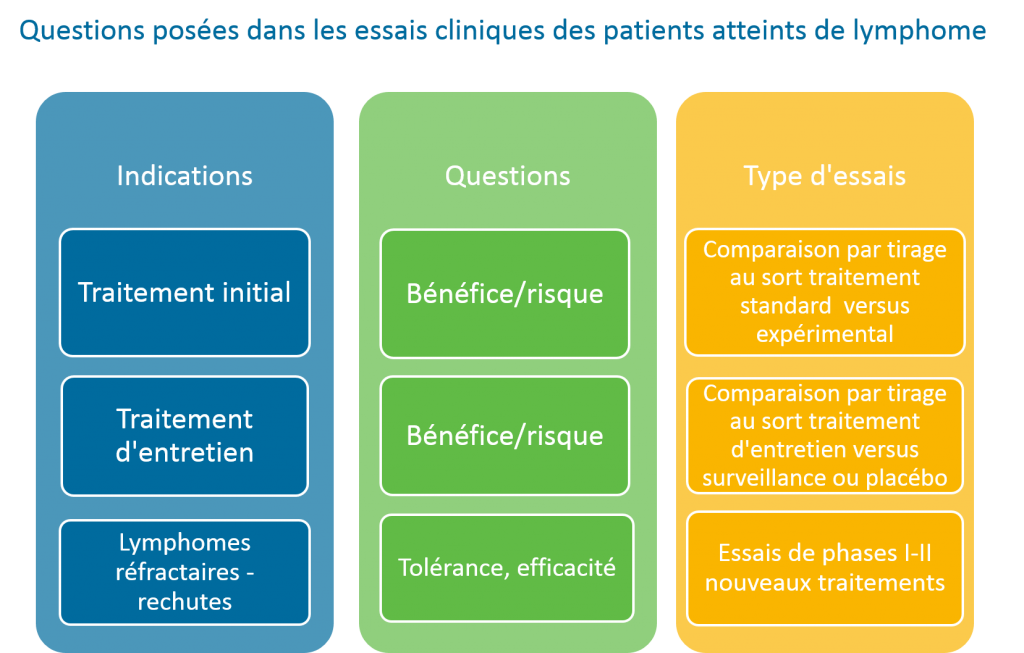
- Evaluer la tolérance d’un nouveau médicament et définir la dose recommandée (essais de phase I).
- Evaluer l’efficacité d’un traitement (essais de phase II).
- Comparer un nouveau traitement avec le traitement standard de référence, en attribuant par tirage au sort à deux groupes comparables de patients l’un ou l’autre des traitements (essais de phase III).
Lorsque les différentes phases de développement sont en faveur du nouveau traitement, un dossier d’enregistrement est soumis aux autorités de santé, en vue d’une autorisation de mise sur le marché (AMM), autorisant la commercialisation du nouveau traitement.
- Définir le traitement de référence d’un lymphome pour un groupe homogène de patients ayant les mêmes caractéristiques et facteurs de risque.
- Améliorer le rapport bénéfice/risque d’un traitement standard de référence, en le comparant à un traitement dit expérimental dont les effets secondaires sont à priori plus réduits (choix des médicaments, réduction du nombre de cycles…) et l’efficacité équivalente.
- Evaluer le rapport bénéfice/risque d’un traitement d’entretien après traitement initial, dans le but de réduire le risque de rechute.
- Evaluer la tolérance et l’efficacité de nouveaux traitements chez les patients dont le lymphome n’est pas contrôlé par le traitement initial.